Veränderungen der aquatischen Lebensgemeinschaft und potenzielle Wechselwirkungen mit der Gewässergüte in der Nister (Siegsystem, Rheinland-Pfalz)
Einführung
Mitte der 1990er Jahre war die Nister (Gewässersystem Sieg) ein außerordentlich fischartenreicher Mittelgebirgsfluss (Äschenregion). Neben diversen stark gefährdeten „Rote-Liste-Arten“ (Rote Liste Rheinland-Pfalz) wie Schneider, Äsche und Nase waren die mittelgroßen Arten Hasel und Gründling sowie die großwüchsigen Arten Barbe und Döbel außerordentlich häufig. Unter den Kleinfischen dominierten Schmerle und Elritze; die Groppe war verbreitet, jedoch nicht in „Massenvorkommen“ vertreten. Die Gewässergüte lag bei GK II (Saprobienindex 1,9). Der Arten- und Individuenreichtum wurde im Wesentlichen mit einer hohen Strukturvielfalt und einer insgesamt guten Wasserqualität begründet.
Eine detaillierte Darstellung dieser als Referenz dienenden Ausgangssituation findet sich in ANHANG I.
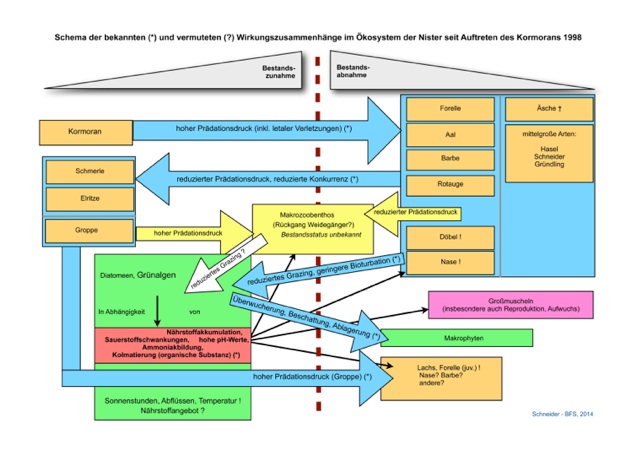
In den Jahren 2009 bis 2013 wurde – trotz unveränderter Nährstofffracht (insbesondere Phosphor (1)) – eine dramatische Verschlechterung der Gewässergüte, pH-Werte bis 9,94 und eine drastisch erhöhte Primärproduktion (insbesondere Grünalgen) dokumentiert. Der dokumentierte Wandel korreliert zeitlich mit dem Zusammenbruch fakultativ und obligat herbivor lebender Fischarten (Nase, Döbel, Rotauge u.a.), die ursprünglich in hohen Dichten vorhanden waren. Allein durch den Rückgang der Nase (Weidegänger) werden nach Schätzung des BFS Frankfurt im Unterlauf der Nister jährlich rund 250 Tonnen pflanzlicher Biomasse weniger konsumiert als Mitte der 1990er Jahre. Die Fischfauna setzt sich heute fast ausschließlich aus Schmerle, Elritze und Groppe zusammen (vielerorts Massenvorkommen). Die verzeichneten Bestandsexplosionen dieser Kleinfische korrelieren wiederum zeitlich mit dem Bestandszusammenbruch fakultativ piscivor lebender Arten wie Barbe, Döbel und Aal. Der Barbe dürfte dabei als substratorientierte großwüchsige Fischart auch durch ihre Wühltätigkeit eine „reinigende“ Funktion durch die Mobilisierung abgestorbener Algen und durch Substratumlagerungen zukommen (Bioturbation). Zudem gibt es Indizien, dass auch das Makrozoobenthos einen erheblichen Rückgang erfahren hat (erhöhter Fraßdruck durch Bestandszunahme der Kleinfische?), was ebenfalls Weidegänger (Grazer) mit einschließen würde.
(1) Mitteilung Fulgor Westermann, LUWG Mainz, 6.12.2011: „Man kann sagen, dass die generell anthropogen erhöhten P-Konzentrationen sich in der Nister seit Anfang der 1990er-Jahre nicht nennenswert (allenfalls eine ganz schwache Tendenz zur Verminderung) verändert haben; sie liegen auch heute auf einem ähnlichen Niveau wie damals. [...] Die Nister weist neben dem Daadenbach die mit Abstand geringsten Nitratkonzentrationen im Jahresmittel und auch bei den Maximalwerten im Vergleich der monatlich beprobten Gewässer in Westerwald und Taunus auf (vgl. Diagramm S. 174 „Gewässerzustandsbericht 2010“, MULEWF 2011). Die Konzentrationen an Nitrat-Stickstoff liegen bei geringen 1,1-1,3 mg/l N (Talmühle Hirtscheid bzw. Mündung, Medianwerte 2009/10). Zwischen 1991 und 2011 ist ein ganz schwach abnehmender Trend der Nitrat-Stickstoffkonzentrationen in der Nister feststellbar.“
Die Veränderung des Fischbestands ist ausführlich in ANHANG II zusammengestellt. ANHANG III beschreibt die Zusammenhänge der Gewässergüte und Fischfauna inkl. der Eutrophierungsanzeichen in 2010.
Offensichtlich wird also das Phänomen der Algenzunahme nicht durch eine Zunahme der Nährstoffe (insbesondere Phosphor), sondern durch eine höhere realisierte Bindung dieser Nährstoffe als Folge eines signifikanten Rückgangs der Konsumenten gesteuert.
Weidegänger regulieren massiv die Zusammensetzung, Stärke und Produktivität des Aufwuchses (Bohle, 1995). Die ansteigende Biomasse der Pflanzen (Produzenten) fixiert viele der Nährstoffe, die ansonsten permanent mit der fließenden Welle aus dem Gewässer ausgespült würden – und setzt sie dann innerhalb kurzer Zeit frei, wenn die Algenbestände im Frühjahr bzw. Frühsommer mit steigenden Wassertemperaturen zusammenbrechen.
Von der Entwicklung akut bedroht ist der letzte im Westerwald bekannte Flussperlmuschelbestand ebenso wie eine Population der Bachmuschel, weiterhin der in einem Wiederansiedlungsprozess befindliche Atlantische Lachs sowie diverse Fließgewässerarten wie Äsche (aktuell verschollen), Schneider u.a.
Insbesondere der Bestand der Flussperlmuschel ist akut vor dem Aussterben bedroht. Beginnend im April 2006 wurden insgesamt 32 lebende Flussperlmuscheln gefunden (Nagel, K.-O., Schwarzer, A., Fetthauer, M. & Schneider, J. (2007): Wiederentdeckung der Flussperlmuschel, Margaritifera margaritifera (L. 1758), im Westerwald (Rheinland-Pfalz).- Schriften zur Malakozoologie 23: 1-6, Cismar). Diese Maximalzahl bekannter Tiere resultiert aus dem Jahr 2008. Seitdem hat sich ihre Zahl wieder reduziert, da keine Neufunde mehr hinzukamen und erste Tiere bereits verstarben. Aktuelle Nachzuchtbemühungen lieferten erste positive Zwischenergebnisse.
Die Situation der Flussperlmuschel und der Bachmuschel ist auf der Internetseite der ARGE Nister e.V. zusammengestellt (www.arge-nister.de).
Um ein „Umkippen“ des Gewässers und den Verlust streng geschützter Arten zu verhindern, müssen umgehend Maßnahmen ergriffen werden. Allerdings ist zu konstatieren, dass die Wirkungszusammenhänge zwischen Konsumenten (Fischfauna, Makrozoobenthos), Produzenten (Algen) und Gewässergüte nur unzureichend bekannt sind. Zur Ursachenforschung und Herausarbeitung effektiver Maßnahmen sollen entsprechend zeitnah - Untersuchungen durchgeführt werden.
Dabei sollen im Schwerpunkt folgende Fragestellungen bearbeitet werden:
-
•Lässt sich die Verschlechterung der Gewässergüte mit dem Bestandszusammenbruch herbivorer Arten erklären bzw. wird das Phänomen der Algenzunahme nicht so sehr durch eine Zunahme der Nährstoffe (insbesondere Phosphor), sondern durch eine höhere realisierte Bindung dieser Nährstoffe als Folge eines signifikanten Rückgangs der Konsumenten gesteuert?
-
•Welcher Zusammenhang besteht zwischen Fischfauna, Makrozoobenthos und Primärproduktion?
-
•Wie effektiv wäre eine Biomanipulation durch eine Wiederherstellung des ursprünglichen Fischbestandes (Referenz 1995) im Hinblick auf die realisierte Trophie der Algen?
-
•Welche Rolle spielt die Groppe als Prädator (Fische, Makrozoobenthos) und wie stark sind die Auswirkungen auf den Reproduktionserfolg von Salmoniden (Lachs, Forelle) und in Folge auf die Abundanz und Dichte der Salmoniden als Wirtsfische für die Flussperlmuschel? Voruntersuchungen weisen auf einen erheblichen Einfluss hin (siehe unten).
-
•Welche kurz- und mittelfristigen Maßnahmen zur Rettung der Großmuschelbestände sind effektiv und nachhaltig?
Gewässerbeschreibung
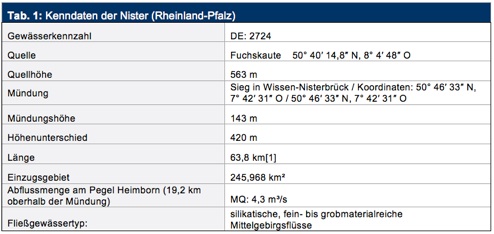
Die Nister gehört zum Gewässersystem der Sieg. Sie entspringt im Hohen Westerwald, fließt stark mäandrierend durch das südliche Mittelsiegbergland und mündet unterhalb von Wissen bei Nisterbrück als Gewässer 2. Ordnung links in die Sieg. Das Einzugsgebiet der knapp 64 km langen Großen Nister umfasst knapp 246 km². Zwischen Nistertal und Mündung ist die Nister der Äschenregion (Hypo-Rhithral) zuzurechnen. Tab. 1 fasst die wesentlichen Gewässerkenndaten zusammen.
Die Nister ist ein typischer Mittelgebirgsfluss (hier: Westerwald; Fließgewässertyp: silikatische, fein- bis grobmaterialreiche Mittelgebirgsflüsse) in Rheinland-Pfalz. (Flüsse dieses Typs prägen die meisten größeren Einzugsgebiete und Täler der Mittelgebirge von Hunsrück, Westerwald und Eifel.) Es dominiert grobes, steiniges Geröll und eine schnelle Strömung. Dieser dynamische Flusstyp weist oft eine typische Abfolge von Schnellen und Stillen auf – d. h. es kommen sowohl flache, schnell strömende als auch tiefe, ruhiger fließende Abschnitte vor. Mit seinem vielgestaltigen Lebensraum bietet dieser Gewässertyp die Grundlage für eine artenreiche Wirbellosenbesiedlung und Fischfauna. Da Mittelgebirgsflüsse wie die Nister in Kontakt mit vielen Nebengewässern stehen, treten hier auch noch viele Arten der kleineren und kühlen Bäche auf (www.geoportal-wasser.rlp.de).
Anmerkung: Anders als Karbonatgewässer sind Silikatgewässer wie die Nister nur schwach gepuffert. Sie sind vergleichsweise nährstoffreich, kalkarm („weiches Wasser“) und entsprechend anfällig für hohe pH-Schwankungen („eutrophierungsanfällig“).
Zeitliche Zusammenhänge
Im Jahr 1994 begann auf Initiative des Landes Rheinland-Pfalz das Projekt Lachs 2000, das die nachhaltige Wiederansiedlung des Atlantischen Lachses in der Nister zum Ziel hat (heute: Lachs 2020). Seit 1998/1999 wurde jährlich eine erfolgreiche natürliche Reproduktion zurückkehrender Lachse belegt. Der größte Reproduktionserfolg wurde in der Saison 2007/2008 verzeichnet.
Mit dem Vordringen des Kormorans Ende der 1990er Jahre wurden zunächst erhebliche Bestandsrückgänge bei großen und (zeitlich verzögert) mittelgroßen Fischarten dokumentiert. Im Rahmen mehrerer Vergrämungsversuche (1999, 2004, 2005) entstand im Auftrag des Landes Rheinland-Pfalz eine umfangreiche wissenschaftliche Dokumentation zur rückläufigen Entwicklung der Fischbestände (siehe unten). Der Kormoran ist noch heute – trotz jährlicher Vergrämungsabschüsse – an der Nister präsent.
Im Jahr 2006 wurde auf Initiative der ARGE Nister eine umfangreiche Kartierung der Großmuschelbestände durchgeführt. Dabei wurde eine kleine Reliktpopulation der vom Aussterben bedrohten Flussperlmuschel entdeckt. Als prioritäre „Tierart von gemeinschaftlichem Interesse, für deren Erhaltung besondere Schutzgebiete ausgewiesen werden müssen“ (Anhang II der „Richtlinie 92/43/EWG des Rates vom 21. Mai 1992 zur Erhaltung der natürlichen Lebensräume sowie der wildlebenden Tiere und Pflanzen“, FFH-Richtlinie) ist zur Rettung der Flussperlmuschel der Nister ein Artenschutzprojekt anhängig.
Im Sommer 2008 wurden im Rahmen der Reproduktionskontrollen (Lachs) die Rauschenstrecken der Nister von der Mündung bis zum ersten Wanderhindernis (Wasserkraftanlage Heuzert) durchgängig befischt (ca. 22 Flusskilometer). Hierbei wurde auch ein besonderes Augenmerk auf den Reproduktionserfolg und die Präsenz anderer Fischarten gelegt. Die Ergebnisse indizierten eine dramatische Verschiebung der relativen Artenzusammensetzung und Abundanz der Fischarten. Neben juvenilen Lachsen der Generation 2008 und 2007 wurden fast ausschließlich Groppen, Schmerlen und Elritzen registriert. Die Äsche konnte hingegen nicht mehr nachgewiesen werden. Jungfische der anderen Arten kamen nur noch sporadisch vor. Erneute Kontrollen im Herbst 2008 wiesen zudem auffällig geringe Überlebensraten der Lachse 0+ auf. Dabei fiel auf, dass die Aufwuchshabitate der Junglachse in hoher Dichte durch die Groppe besiedelt waren, wobei große Groppen (> 10 cm) besonders häufig waren. Der Groppe dürfte als Fressfeind eine bedeutende Rolle in der verzeichneten Lachsbestandsreduktion zukommen (Krau, 2011).
In 2009 wurde der Fischbestand im Allgemeinen und der Groppenbestand im Besonderen semiquantitativ erfasst und mit dem Fischbestand 1995 verglichen (gleiche Methoden). Dabei zeigte sich für die Groppe eine Verzwanzigfachung (!) des Bestandes. Ähnlich verhielt es sich mit Schmerle und Elritze. Fast alle anderen – ursprünglich häufigen – Arten wiesen bestandsgefährdende Rekrutierungsdefizite auf (Nase, Schneider, Hasel, Gründling, bedingt auch Döbel) oder waren ganz verschwunden (Äsche, Barbe, Rotauge, Aal).
Im Sommer 2011 wurde der Groppenbestand in repräsentativen Rauschenstrecken quantitativ erfasst (Krau, 2011). Dabei wurden für Groppen ≥ 6 cm Dichten von bis zu 4,5 Individuen pro m2 dokumentiert. Die Bestandssituation der weiteren Arten entsprach im Wesentlichen den Befunden in 2009: Die Kleinfische Elritze und Schmerle waren sehr häufig; für die Arten Schneider, Lachs, Döbel und Gründling gelangen lediglich Einzelnachweise; Nase, Barbe, Rotauge, Aal, Hasel und Äsche wurden nicht vorgefunden.
Der Zusammenbruch der mittel- und großwüchsigen Fischarten erfolgte dabei zeitlich vor der drastischen Verschlechterung der Wasserqualität (siehe ANHANG II und III).
Die extreme Zunahme der Groppe (wie auch der weiteren Kleinfische Elritze und Schmerle) in der Nister korreliert zeitlich mit dem Bestandszusammenbruch der insecti-piscivoren Barbe in der Nister. Auch die Bestände anderer Fressfeinde der Groppe (Döbel, Aal) gingen in den letzten Jahren drastisch zurück. Insbesondere der Barbe dürfte als Fressfeind (und damit als effektiver Bestandsregulator) eine erhebliche Bedeutung zukommen.
Neben dem Bestandszusammenbruch der großen und mittelgroßen Fischarten wurde in den letzten 10 Jahren eine in der Tendenz zunehmende Algenentwicklung (Eutrophierung) beobachtet. Diese begann zunächst mit einer Zunahme von Diatomeen und Phytobenthos. In 2009 und besonders in 2010 vermehrten sich schließlich die Fädigen Grünalgen explosionsartig. Die Folge waren extrem hohe pH-Werte (2011 bis nahe pH 10,0) und starke Sauerstoffschwankungen.
Erläuterungen:
-
a)Die Photosyntheseaktivität der Algen und Makrophyten entzieht dem Wasser tagsüber Kohlensäure, wodurch der pH-Wert steigt, und setzt Sauerstoff frei (bis über 200 % Sättigung), während nachts der pH-Wert wieder fällt und der Sauerstoff durch den Verbrauch der gesamten Biozönose wieder sinkt. Mit Veränderung des pH-Wertes verändert sich auch das Verhältnis Ammonium/Ammoniak. Steigt der pH-Wert, steigt auch der Anteil des hoch fischgiftigen Ammoniaks. Sinkt der pH-Wert, wandelt sich das giftige Ammoniak wieder in ungiftiges Ammonium um.
-
b)Eutrophierung = Steigerung der pflanzlichen Primärproduktion = Veränderung der Qualität und Quantität der energetischen Basis des Nahrungsnetzes. Eutrophierung ist eine Veränderung im Ökosystemstoffwechsel und kein ausschließliches Nährstoff und Pflanzenproblem! Es ist zwischen Trophiepotenzial (P-Verfügbarkeit) und realisierter Trophie (Eutrophierung) zu unterscheiden.
Fragestellungen und Hypothesen
Gemäß einer Literaturrecherche des BFS liegen über diverse trophische Prozesse und Räuber-Beute-Beziehungen in Fließgewässern nur unzureichende Erkenntnisse bzw. teilweise widersprüchliche Erkenntnisse vor. Exemplarisch können für den konkreten Fall der Eutrophierungstendenzen und gestörten Fischartenzusammensetzung in der Nister folgende Fragestellungen und Hypothesen formuliert werden (Literatur: siehe ANHANG III):
Nahrungsspektrum der Barbe, potenzielle Räuber-Beute-Beziehung mit Kleinfischen (insbesondere Groppe).
Hypothese: Der Bestandszusammenbruch der Barbe und die Bestandsexplosion der Groppe stehen im Sinne eines Top-Down-Effekts direkt miteinander in Verbindung.
Begründung: Barben als benthivore Art regulieren über den Fraßdruck auf juvenile Groppen deren Bestand (Groppen < 2 cm werden mit dem Makrozoobenthos aufgesaugt). Ältere Barben leben zudem fakultativ piscivor und könnten auch einen Fraßdruck auf mittelgroße bis große Groppen ausüben. Als effektive Fressfeinde der Groppe werden in der Literatur explizit die Arten Aal, Döbel, Hecht, Flussbarsch und Forelle genannt; die Barbe fehlt in diesen Aufstellungen, obgleich sie die stärkste Habitatüberlappung mit der Groppe aufweist und bekannt ist dass die Barbe auch „Kleinfische“ frisst. In der Nister kamen Mitte der 1990er Jahre der Döbel (sehr häufig) und der Aal (regelmäßig) vor (vgl. Tab. 2 in ANHANG I).
Unklarheit besteht zudem über den Anteil pflanzlicher Nahrung und den Einfluss der Barbe auf Weidegänger des Makrozoobenthos.
Nahrungsspektrum der Groppe, potenzieller Fraßdruck auf juvenile Lachse, Forellen und Äschen.
Hypothese: Die Überlebensrate der juvenilen Lachse in der Nister ist aufgrund eines massiven Fraßdrucks durch die Groppe rückläufig.
Begründung: Ältere Arbeiten aus Österreich wiesen darauf hin, dass der „schlechte Ruf“ der Groppe als Laich- und Jungfischräuber unbegründet sei. Konträr wird in Untersuchungen von Ward et al. (2008) ein erheblicher negativer Einfluss der Groppe auf die Überlebensrate von Lachsbrütlingen dokumentiert. In der Nister wiesen wild aufgekommenen Lachse in 2008 – insbesondere in typischen „Groppenhabitaten“ mit hohem Deckungsangebot - extrem niedrige Überlebensraten auf. Schneider fand zudem in der Kleinen Nister im Schlund einer ca. 11 cm langen Groppe einen ca. 7 cm langen, auf Naturvermehrung zurückgehenden Lachsparr (Schneider, 2009). Krau (2011) dokumentierte einen erheblichen Fraßdruck der Groppe auf Besatzlachse in der Nister (Freilandexperimente) und in parallelen Hälterversuchen [Krau, F. (2011): Einfluss der Groppe (Cottus rhenanus) auf Überlebensrate und Wachstum juveniler Atlantischer Lachse (Salmo salar). – Masterarbeit, Universität Rostock; 101 S.]. Es wird daher postuliert, dass der explosionsartig angestiegene Groppenbestand (Abb. 3k) einen erheblichen negativen Einfluss auf den Rekrutierungserfolg wild aufkommender Lachse und auf Besatzlachse (frühe Lebensstadien) hatte bzw. weiter ausübt. Die Forelle und ggf. die Äsche dürften hiervon ebenfalls betroffen sein. Forelle und ggf. Lachs sind als einzige Wirtsfische für die Flussperlmuschel von herausragender Bedeutung für die Rettung der Art in der Nister.
Weidegänger, Bioturbation und Vegetation
Hypothese: Das weitgehende Fehlen großer herbivorer und stöbernder Fische (Nase, Barbe, Döbel, Rotauge u.a.) ist maßgeblich für das extreme Algenaufkommen in der Nister verantwortlich; eine Reduktion der Nährstofffracht (insbesondere P) hätte bei dem aktuell vorliegenden defizitären Fischbestand kaum positive Auswirkungen.
Begründung: Über den Einfluss weidender Makrozoobenthosorganismen auf das Algenwachstum in Fließgewässern liegen einige Untersuchungsberichte vor. Eine in diesem Kontext besonders interessante Beobachtung ist, dass es allein bei Ausfall des Makrozoobenthos (z.B. durch Vergiftung mit Insektiziden) zu einem extremen Grünalgenwachstum kommen kann (Zwick, 1992). Damit ist für diese trophische Kaskade ein typischer Top-Down-Effekt bekannt. Ähnliche regulatorische Mechanismen sind für Fische bisher nur in abgeschlossenen Stillgewässern (Seen verschiedenen Typs) beschrieben. Hier bestehen über fischereiliche Bewirtschaftungsmaßnahmen im Sinne einer Biomanipulation direkte Einflussmöglichkeiten, z.B. zur Sanierung. Für offene Systeme wie Fließgewässer liegen nur wenige Angaben vor. Arbeiten von Power et al. (1985) und Stewart (1987) zeigten jedoch, dass allein die An- bzw. Abwesenheit eines Algen abweidenden Kleinfisches einen starken Einfluss auf das Algenwachstum eines kleineren Fließgewässers in den U.S.A. hat. Besonders interessant ist hierbei, dass der herbivore Kleinfisch selbst bei zusätzlicher Düngung der Versuchsstrecke (mit K, N und P) das Algenwachstum vollständig unterdrücken konnte (!). Es besteht folglich die Möglichkeit, dass es auch in der Nister eine starke Interaktion zwischen herbivoren Fischen und Algenaufkommen gibt und dass der Einfluss der Fische (insbesondere Nase und Döbel) den des weidenden Makrozoobenthos weit übertrifft. Hierbei sind natürlich auch diverse Wechselwirkungen denkbar.
Bioturbation ist das Durchwühlen und Durchmischen (Turbation) von Böden oder Sedimenten durch Lebewesen. Hier dürften drei Aspekte von Bedeutung sein: Eine Lockerung des Sediments durch Fische (insbesondere Barbe) führt zum Ausspülen von Feinsedimenten (Statzner, 2011) und erhöht so im Kieslückensystem die Verfügbarkeit von Sauerstoff. Außerdem wird durch die Umlagerungsprozesse das Algenaufkommen gehemmt. Hinzu kommt eine Beeinflussung der Artenzusammensetzung und Vielfalt des Benthos und damit der Nahrungskette, an deren Spitze viele Fische stehen.
Nach unserer Kenntnis fehlt bisher eine Quantifizierung des Einflusses herbivorer Fische auf das Algenwachstum in Fließgewässern des Mittelgebirges sowie Studien zur Wechselwirkung Makrozoobenthos (Weidegänger, Räuber), Fische (Weidegänger, benthivore Arten, Bioturbation), Primärproduktion und Nährstoffangebot.
Durch Freiland- und Laborexperimente innerhalb des Forschungsprojektes „Ökosystemare Zusammenhänge im Hyporhitral anthropogen belasteter Fließgewässer“ konnte nachgewiesen werden, dass die interstitielle Fauna im Hyporheal durch Fraß- und Wühltätigkeit zur einer Dekolmation (Lockerung des Sohlenmaterials) des Interstitials (Lückensystems) beiträgt und dadurch auch den Austausch von Sauerstoff zwischen fließender Welle und Interstital begünstigt (Schmidt et al. 2009). Bei euthropierten Gewässern reduzieren vor allem der Algenaufwuchs (Diatomeen) die Fließgeschwindigkeiten innerhalb des Interstitials und die Austauschprozesse mit der fließenden Welle (Ibisch et al. 2009). Der durch den Aufwuchs verminderte Stoffaustausch auf der Substratoberfläche dürfte einen negativen Einfluss auf die interstitielle Fauna haben und deren funktionale Rolle bei der Dekolmation des Interstitials drastisch reduzieren. Als Folge davon wäre eine deutliche Herabsetzung der mikrobiellen Stoffumsätze im Interstitial bzw. „Selbstreinigung des Wassers“ im Interstital zu erwarten.
In der oberen Lahn wurde bereits dokumentiert, dass sich der Algenteppich im Spätfrühjahr innerhalb weniger Tage irgendwann ablöst und das Interstitial durch die kleinen Algenpartikel verstopft wird. Dies hat sinkenden Sauerstoffwerte im Interstitial zur Folge (Hübner et al. 2009). Ob vergleichbare Vorgänge in der Nister eine wesentliche Rolle für das Verschwinden der Äsche und die Vermehrungsausfälle des Lachses und der Flussperlmuschel spielen, soll innerhalb dieses Projekts untersucht werden.
Es erscheint wenig wahrscheinlich, dass die skizzierte negative Entwicklung allein durch eine Wiederherstellung der Fischbestände rückgängig gemacht werden kann. Vielmehr müssen auch die Belastungsquellen konsequent identifiziert werden und die Nährstoffbelastung reduziert werden (insbesondere Phosphoreinleitungen). Mittelfristig muss zudem die Beschattung des Gewässers durch Anlage eines Gehölzsaums verbessert werden (auch Reduktion der thermischen Belastung). Gelingt dies nicht, ist die Verfehlung des Ziels eines guten ökologischen Zustands im Sinne der EU-WRRL bis 2015 zwangsläufig. Auch die Ziele einer nachhaltigen Etablierung des Lachses auf Populationsniveau sowie die Rettung der Restpopulation der Flussperlmuschel in der Nister sind (wie auch andere Artenschutzziele) bei einem Andauern der negativen Entwicklung nicht umsetzbar.
Das nachfolgende Schema der trophischen Wechselwirkungen / Kaskade fasst den Kenntnisstand und die Hypothesen zusammen (das Schema kann in News & Archiv heruntergeladen werden: NisterTrophieschemaBFS2014.pdf).
ANHANG I - Ausgangssituation: Ichthyofauna und Gewässergüte 1994-1996
Die Nister wurde im Rahmen des Projektes Lachs 2000 intensiv untersucht; die Methoden und Ergebnisse finden sich in Schneider, 1998.
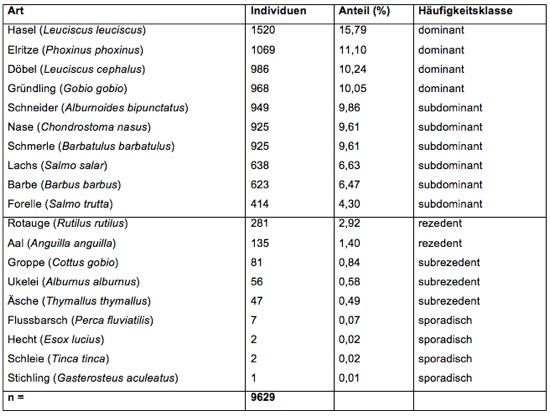
Fischfauna: Der Gesamtfang in der Nister betrug im Zeitraum 1994-1996 insgesamt 9.629 Individuen; das Artenspektrum war mit 19 Spezies sehr weit gefächert. Auffällig war die relativ geringe Abundanz der Salmoniden Äsche und Forelle, die einen Gesamtanteil von 4,79% ausmachten. Die Äsche als Leitfisch der vorliegenden Gewässerregion kam subrezedent (0,49%) vor, war jedoch regelmäßig in den Fängen vertreten. Die Cypriniden (n= 7.379) machten 76,63% des Fangs aus. Elritze und Schmerle waren örtlich massenhaft vertreten. Bemerkenswert war die relative Häufigkeit (9,86%) des landesweit in seinem Bestand gefährdeten Schneiders. Überall häufig waren die großwüchsigen Arten Nase und Barbe mit 9,61% bzw. 6,47% Anteil am Gesamtfang (subdominant). Aufgrund von Besatzmaßnahmen war der Lachs mit 6,63% subdominant vertreten (nur juvenile Individuen). Die ebenfalls durch Besatz gestützte Forelle war mit 4,30% am Gesamtfang beteiligt (Tab. 2). Die Groppe erreichte einen Anteil von lediglich 0,84% (subrezedent). Fehlarten: Bachneunauge, Quappe.
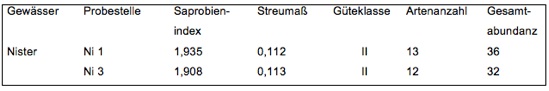
Gewässergüte 1995 (vgl. Schneider, 1998): Die Einstufung der Makroevertebraten (DIN 38410) ergab für zwei Probestellen (Mündungsbereich, Ni 1; Helmeroth, Ni 3) Saprobienindizes zwischen 1,908 und 1,935. Die Güteklasse lag in beiden Strecken bei GK II (Tab. 3).
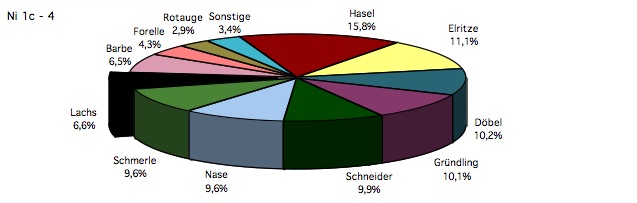
Abb. 1: Relative Abundanz der nachgewiesenen Fischarten in der Nister Ni 1c-Ni 4 im Untersuchungszeitraum 1994-1996; n= 9.629 (aus Schneider, 1998).
Tab. 2: Häufigkeitsklassen der nachgewiesenen Fischarten in der Nister Ni 1c-Ni 4 im Untersuchungszeitraum 1994-1996 (aus Schneider, 1998).
Tab. 3: Saprobienindex, Güteklasse, Artenanzahl und Gesamtabundanz an zwei Probestellen der Nister im Jahr 1995 (aus Schneider, 1998).
Literatur
Schneider, J. (1998): Zeitliche und räumliche Einnischung juveniler Lachse (Salmo salar Linnaeus, 1758) allochthoner Herkunft in ausgewählten Habitaten. - Verlag Natur und Wissenschaft, Solingen; 218 pp.
ANHANG II - Entwicklung der Ichthyofauna (Stand 2011)
Eine in 2009 durchgeführte Fischbestandserhebung an vier Probestellen, die bereits 1995 untersucht wurden, belegt den (seit dem Auftreten des Kormorans im Siegsystem verzeichneten) Wandel der Fischartengemeinschaft (vgl. Schneider & Korte, 2004). Bei der Kontrolle 2009 wurde dieselbe Methode wie 1995 angewandt - inkl. der Verwendung von DEKA 3000 Impulsstrom-Elektrofischereigeräten. Diese Geräte weisen eine geringere Fängigkeit auf als die modernen, heute vom BFS verwendeten Gleichstromgeräte der Firma Bretschneider. Die Abb. 2 und 3a-k stellen die Ergebnisse 1995 und 2009 gegenüber.
Die Erhebung 2009 zeigte einen drastischen Rückgang der großen und mittelgroßen Arten bei gleichzeitiger
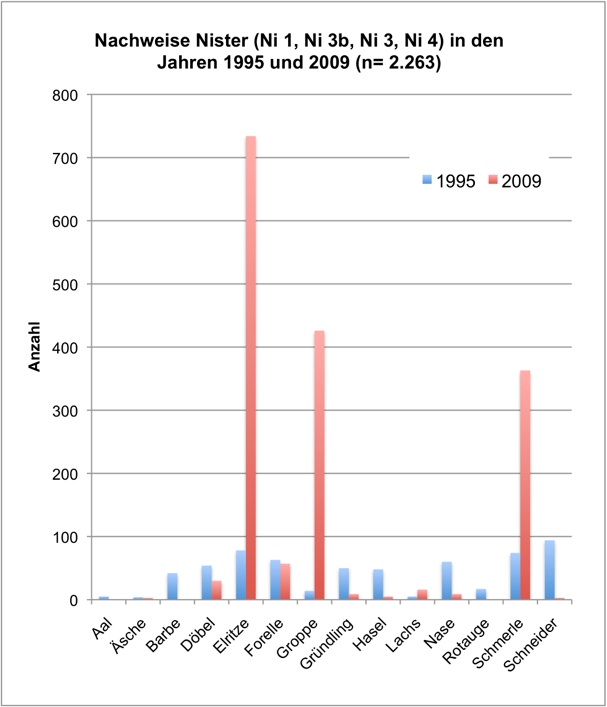
Abb. 2: Nachweise Nister 1995 und 2009 (Befischungsstrecke 400 m)
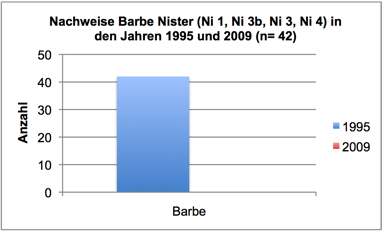
Abb. 3a: Nachweise Barbe, Nister 1995 und 2009 (Befischungsstrecke 400 m)
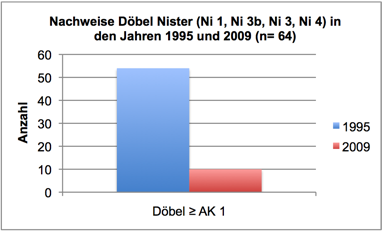
Abb. 3b: Nachweise Döbel, Nister 1995 und 2009 (Befischungsstrecke 400 m)
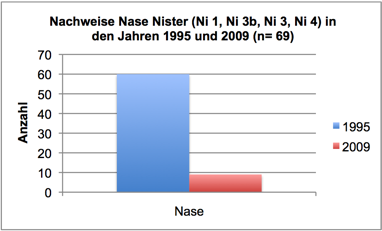
Abb. 3c: Nachweise Nase, Nister 1995 und 2009 (Befischungsstrecke 400 m)
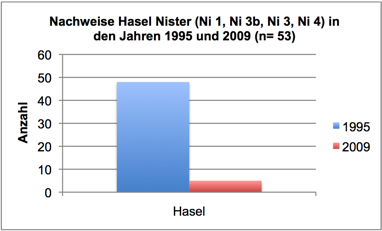
Abb. 3d: Nachweise Hasel, Nister 1995 und 2009 (Befischungsstrecke 400 m)
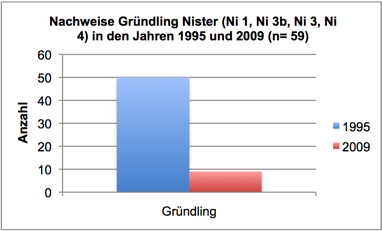
Abb. 3e: Nachweise Gründling, Nister 1995 und 2009 (Befischungsstrecke 400 m)
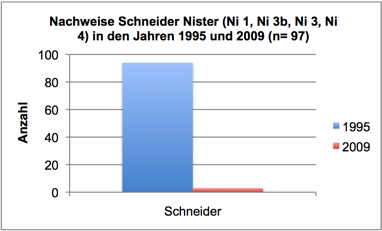
Abb. 3f: Nachweise Schneider, Nister 1995 und 2009 (Befischungsstrecke 400 m)
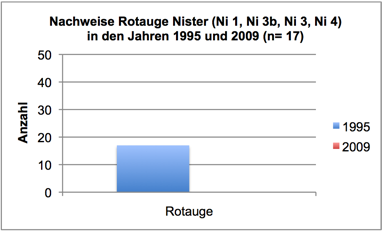
Abb. 3g: Nachweise Rotauge, Nister 1995 und 2009 (Befischungsstrecke 400 m)
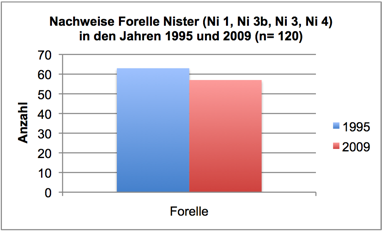
Abb. 3h: Nachweise Forelle, Nister 1995 und 2009 (Befischungsstrecke 400 m)
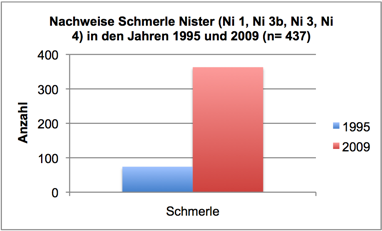
Abb. 3i: Nachweise Schmerle, Nister 1995 und 2009 (Befischungsstrecke 400 m)
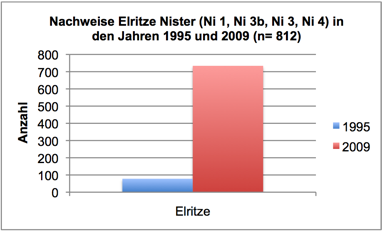
Abb. 3j: Nachweise Elritze, Nister 1995 und 2009 (Befischungsstrecke 400 m)
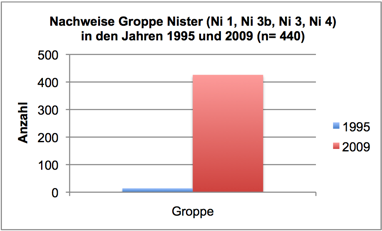
Abb. 3k: Nachweise Groppe, Nister 1995 und 2009 (Befischungsstrecke 400 m)
In Anbetracht der starken Zunahme der Groppe (vgl. Abb. 3k) und der verzeichneten Habitatüberlappung ist davon auszugehen, dass in der Nister nicht nur Eier und Larven (vgl. Palm et al., 2009) sondern auch juvenile Lachse der AK 0+ in (sog. Sömmerlinge) erheblichem Ausmaß durch die Groppe dezimiert werden (vgl. Krau, 2011).
Literatur
Krau, F. (2011): Einfluss der Groppe (Cottus rhenanus) auf Überlebensrate und Wachstum juveniler Atlantischer Lachse (Salmo salar). – Masterarbeit am Institut für Biowissenschaften - Zoologie Studiengang Master of Science Meeresbiologie, Universität Rostock; 101 p.
Palm, D., Lindberg, M., Brännäs, E., Lundqvist, H., Östergren, J. & Carlsson, U. (2009): Influence of European sculpin, Cottus gobio, on Atlantic salmon Salmo salar, recruitment and the effect of gravel size on egg predation – implications for spawning habitat restoration. - Fisheries Management and Ecology, 16: p. 501–507.
Schneider, J. & Korte, E. (2004): Letale Vergrämung von Kormoranen im Einzugsgebiet der rheinland-pfälzischen Sieg und Nister - Studie im Auftrag der Struktur- und Genehmigungsdirektion Nord; Frankfurt a. M., 55 pp.
Schneider, J. (2005): Letale Vergrämung von Kormoranen im Einzugsgebiet der rheinland-pfälzischen Sieg und Nister in 2004/2005. - Studie im Auftrag der Struktur- und Genehmigungsdirektion Nord; Frankfurt a. M., 47 pp.
Schneider, J. (2009): Erfolgskontrolle der Wiedereinbürgerung von Lachs (Salmo salar L.) und Meerforelle (Salmo trutta L.) in Sieg, Saynbach, Ahr und Lahn (Rheinland-Pfalz). - Projektphase V, 1. Zwischenbericht. Im Auftrag des Landes Rheinland-Pfalz. Frankfurt a. M., 79 pp.
ANHANG III - Zusammenhang Gewässergüte und Fischfauna
Eutrophierung im Jahr 2010 und 2011
Die Gewässerbelastung zeigte sich in 2010 bereits Mitte März in einem starken Algenaufwuchs (Kiesel- und fädige Grünalgen). Insbesondere das Grünalgenaufkommen nahm bis April örtlich stark zu. Damit einhergehend wurden im Frühjahr 2010 in Nister, Kleiner Nister und Wisserbach stark erhöhte pH-Werte (bis pH 9,6) gemessen und ein weiteres massives Aufkommen fädiger Grünalgen festgestellt (vgl. Abb. 4). Am frühen Abend des 1. Mai 2010 wurde bei Stein-Wingert der höchste Wert mit pH 9,6 ermittelt. Am darauf folgenden Morgen wurde an dieser Probestelle noch pH-Wert von 9,0 gemessen. Der Bereich unterhalb des Wehres war in Bereichen geringer Strömung nahezu flächendeckend mit Grünalgen besiedelt. Im Bereich der Ortslage Thal wurde am Morgen des 2. Mai 2010 pH 9,1 nachgewiesen (Mittags- und Abendwerte müssen höher eingeschätzt werden, vgl. Messungen Stein-Wingert). Der Gewässerabschnitt in Thal war im Vergleich zu den beiden letzten Jahren ebenfalls deutlich flächiger von Grünalgenaufkommen geprägt. An der Kleinen Nister war insbesondere die Probestelle in der Ortslage Limbach mit pH 9,1 auffällig. Im Wisserbach (Mündung) wurde am 29.4.2010 (17:30 Uhr) ein pH-Wert von 9,5 dokumentiert. In der Nister lag der höchste pH-Wert am selben Tag (18:00 Uhr) ebenfalls bei 9,5 (100 m unterhalb Wehr Dalex) (Nagel & Hugo, 2011).


Abb. 4b: Zeichen einer massiven Eutrophierung der Nister Ende April - Anfang Mai 2010

Abb. 4b: Zeichen einer massiven Eutrophierung der Nister Ende April - Anfang Mai 2010

Abb. 4c: Zeichen einer massiven Eutrophierung der Nister: abgestorbene Algen bilden einen Schlammteppich und versiegeln das Interstitial (Kieslückensystem).
Das flächige Grünalgenaufkommen wurde - wenn auch in etwas abgeschwächter Form - auch an Kleiner Nister und Wisserbach verzeichnet. In allen drei Gewässern (und möglicherweise auch in der Sieg) führte das Absterben der Algen Ende April bis Mitte Mai auch zu einer erheblichen Kolmation des Kieslückensystems. Da die Entwicklung der Salmonidenbrut aufgrund des langen und kalten Winters 2009/2010 zeitlich deutlich verzögert erfolgt sein dürfte (Emergenz wahrscheinlich frühestens Ende April) waren die verzeichneten Reproduktionsausfälle sehr wahrscheinlich nicht nur den hohen pH-Werten, sondern auch der Versiegelung des Interstitials durch absterbende Algen geschuldet.
Die Ursachen der Eutrophierung bzw. der massiven Algenentwicklung sind noch nicht abschließend geklärt. Nach LUWG (Herr Westermann) liegt an der Nister eine erhöhte Phosphatbelastung vor, die für die seit Jahren verzeichnete Algenentwicklung (mit) verantwortlich sein dürfte. Allerdings seien die Phosphorbelastungen seit 1995 im Wesentlichen unverändert (!). Die besonders extreme Grünalgenentwicklung im Frühjahr 2010 und 2011 wurde zudem durch die kalten Wassertemperaturen (Fädige Grünalgen sind eher „kälteliebend“) und die geringe Beschattung begünstigt. Aufgrund des langen Winters war die Entwicklung der Vegetation in 2010, insbesondere die Blattbildung der Laubbäume, stark verzögert. Die Ausbringung von Gülle auf noch halb gefrorenem Boden dürfte ebenfalls eine wichtige Rolle gespielt haben. Andauernder Hochdruckeinfluss im April 2010 führte außerdem zu geringen Abflüssen (Nährstoffkonzentration erhöht) und zu einer besonders intensiven Sonneneinstrahlung.
Allerdings wurde trotz des Neubaus von Kläranlagen und dem fortgeschrittenen Anschluss von Haushalten an das Abwassersystem just in den letzten 12 Jahren eine in der Tendenz zunehmende Algenentwicklung beobachtet. Diese begann zunächst mit einer Zunahme von Diatomeen und Phytobenthos. In 2009 und besonders in 2010 vermehrten sich schließlich die Fädigen Grünalgen explosionsartig. Ob gegenüber den 1990er Jahren bis 2009/2010 Einleitungsquellen (z.B. Agrarbetriebe bzw. Großvieheinheiten) in einer Größenordnung neu hinzugekommenen sind, die das Phänomen der drastischen Verschlechterung der Gewässergüte hinreichend erklären, ist zweifelhaft - insbesondere auch deshalb, weil sich das Phänomen der Algenzunahme in abgeschwächter Form auch auf Kleine Nister und Wisserbach erstreckt. Auch sind Zweifel an der monokausalen Deutung angebracht, dass die Primärproduktion direkt abhängig vom Phosphorgehalt im Gewässer ist.
Die Fischfauna als potenzieller Regulationsfaktor
Interessant ist im Kontext der Eutrophierung, dass die Zunahme der Algen in den letzten 12 Jahren zeitlich mit einem Bestandszusammenbruch diverser Fischarten in Nistersystem und Wisserbach korreliert. Die Bestandsrückgänge in der Nister begannen bereits Ende der 1990er Jahre und waren eine direkte Folge des Fraßdrucks des Kormorans (Schneider & Korte, 2004; Schneider, 2005). Betroffen waren zunächst größere und mittelgroße Arten, wie Barbe, Nase, Döbel und Hasel. Profitiert haben davon offenbar Kleinfische. Wie in Schneider (2009) ausführlich dargestellt, verdeutlicht eine in 2009 durchgeführte Fischbestandserhebung an vier Probestellen, die bereits 1995 untersucht wurden, einen erheblichen (seit dem Auftreten des Kormorans im Siegsystem verzeichneten) Wandel der Fischartengemeinschaft (vgl. Schneider & Korte, 2004). Barbe, Nase, Döbel und Hasel erreichten 2009 lediglich 5-15% der 1995 vorhandenen Bestandsdichten. Dagegen erhöhten sich die Bestände der Kleinfische (insbesondere Groppe) um das 5- bis 20fache. Wie dieser Wandel der Fischartengemeinschaft mit der Zunahme an Algen in Zusammenhang stehen könnte, soll am Beispiel der Arten Nase, Döbel, Rotauge und Barbe beleuchtet werden:
Die Nase ist vorwiegend Vegetarier und dabei ein echter Nahrungsspezialist, der insbesondere Algen von hartem Substrat abweidet (Grazer). Mit ihrem harten Unterkiefer und der scharfen Unterlippe (Abb. 5) können Nasen dabei nicht nur „weiche Algen“ (z.B. Grünalgen) abweiden, sondern auch Diatomeen. Während der Fressperioden suchen die Nasen oft schwarmweise verschiedene Weideplätze auf. Seltener fressen sie auch Kleintiere, die sich am Grund aufhalten. Durch großflächiges Abweiden in Schwärmen von bis zu 1.000 Tieren hält die Nase den Untergrund von übermäßigem Algenbewuchs frei (Abb. 6).
Welche Mengen pflanzliche Nahrung die Nase in Relation zu ihrem Körpergewicht aufnimmt, ist bisher noch nicht untersucht. Um eine Arbeitshypothese aufzustellen, wurde angenommen, dass die Nase täglich rund 10% ihres Körpergewichts abweidet. Schwerpunkt der Nahrungsaufnahme seien 180 Tage im Jahr – unberücksichtigt bleiben Zeiträume geringerer Aktivität (die Nase beginnt im Frühjahr bereits ab ca. 3°C Wassertemperatur mit der Nahrungsaufnahme!). Eine durchschnittliche Nase wiegt 500 g (bei einer Länge von 35-45 cm). Setzt man diese Werte mit der ehemaligen Bestandszahl von 30.000 adulten Nasen in der Nister in Bezug, ergibt dies 30.000 mal 50 g Algen = 1,5 Tonnen am Tag oder 270 Tonnen im Jahr (!). Das würde bedeuten, dass in der Nister zwischen Mündung und Marienstatt rund 215 Tonnen pflanzlicher Biomasse (Algen) schon bei einem Bestandsrückgang von 80% (Stand 2004) in einer Wachstumsperiode nicht mehr abgeweidet wurden. Nicht berücksichtigt wird in dieser Kalkulation, dass die Nase vorrangig den dünnen „Algenrasen“ (insbesondere Diatomeen) abweidet, also pflanzliche Organismen entnimmt, bevor sie auswachsen (und sich ihre Biomasse noch einmal vervielfacht). Auch die anderen Fischarten, die teilweise in erheblichem Ausmaß Pflanzen aufnehmen, wie Döbel und Rotauge (teilweise auch Barbe), sind in dieser Kalkulation noch nicht enthalten.

Abb. 5: Maul der Nase – zum Abweiden von Kieselalgen ist die Unterlippe scharfkantig und verhornt
Während die Nase insbesondere Diatomeen abweidet und vermutlich auf diese Art auch einen dezimierenden Einfluss auf das Grünalgenwachstum hat, können für Döbel und Rotauge Fädige Grünalgen einen erheblichen bis dominanten Anteil der Nahrung ausmachen (Balestrieri et al., 2006). Damit kommt insbesondere dem ehemals sehr häufigen und mit erheblicher Biomasse vertretenem Döbel eine sehr wichtige Rolle in der Regulation der Fädigen Grünalgen zu (vgl. Abb. 4).

Abb. 6: Zeichen einer Fraßspuren der Nase in der Nister – selbst kleinere Steine und Grobkies werden abgeweidet
Die mit dem zunehmenden Algenwachstum verbundene Biomassenakkumulation führt schließlich zu instabilen Sauerstoffgehalten im Gewässer, was wiederum einen negativen Effekt auf Fische und Makrozoobenthosorganismen hat. Bei einer zunehmenden Schädigung der Weidegänger des Makrozoobenthos, die durch das sog. grazing ebenfalls in erheblichem Maße Algen aufnehmen, tritt nachfolgend der Fraßdruck dieser Konsumentengruppe möglicherweise zunehmend in den Hintergrund.
Ein weiterer Aspekt ist der mechanische Einfluss von Fischen (Bioturbation) auf das Algenwachstum - insbesondere, wenn größere Individuen in hohen Dichten vorkommen. Möglicherweise hemmt insbesondere die benthivore Barbe durch ihren Substratkontakt (Stöbern, Umlagern von Kies) bei der Nahrungsaufnahme das Algenwachstum (vgl. Statzner, 2011). Nach eigenen Beobachtungen sind Fraßplätze der Barbe (wie auch Laichplätze von Barbe und Nase) häufig durch besonders geringen Bewuchs mit Diatomeen und Grünalgen charakterisiert. Diese mechanische „Reinigung“ von Substraten dürfte gerade zu Beginn des Algenwachstums besonders effektiv sein. Nach dem drastischen Rückgang des vormals individuenreichen Bestands der Barbe in der Nister (42 Nachweise in 1995, keine Nachweise 2009; vgl. Abb. 3a in ANHANG II) könnte dieser Einflussgröße eine nicht unerhebliche Bedeutung zukommen.
Literatur
Balestrieri, A.; Prigioni, C.; Remonti, L.; Sgrosso, S. & Priore, G. (2006): Feeding ecology of Leuciscus cephalus and Rutilus rubilio in southern Italy. - Italian Journal of Zoology, 73:2, 129-135.
Bohle, H.W. (1995): Limnische Systeme. - Spezielle Ökologie; Springer Berlin Heidelberg, 267 p.
Hübner, D. (2003): Die Ablaich- und Interstitialphase der Äsche (Thymallus thymallus L.) – Grundlagen und Auswirkungen anthropogener Belastungen- Dissertation Universität Marburg, 178 S.
Hübner, D., Borchardt, D. & Fischer, J. (2009): Cascading effects of eutrophication on intragravel life stages of European Grayling (Thymallus thymallus L.). Arch. Hydrobiol. (Advances in Limnology): The ecology of the hyporheic zone of running waters. Patterns, processes and bottleneck functions: 205-224.
Ibisch, R.B., Seydell, I. & Borchardt, D. (2009): Influence of periphyton biomass dynamics on biological colmation processes in the hyporheic zone of a gravel bed river (River Lahn, Germany). Arch. Hydrobiol. (Advances in Limnology): The ecology of the hyporheic zone of running waters. Patterns, processes and bottleneck functions: 87-104.
Nagel, K.O. & R. Hugo (2011): Artenschutzprojekt „Flussperlmuschel und Bachmuschel in der Nister“. Projektphase 2010/2011. (Bestandsstützung, Biotopentwicklung). Auftraggeber: SGD Nord, Obere Fischereibehörde, Koblenz; unveröffentlichter Projektbericht.
Power, M.E.; Matthews, W.J. & Stewart, A.J. (1985): Grazing Minnows, Piscivorous Bass, and Stream Algae: Dynamics of a Strong Interaction. - Ecology, Vol.66, No.5, pp. 1448-1456.
Schmidt, J., Borchardt, D., Ibisch, R.B., & Bohle, H.W. (2009): Direct measurements of respiration and decolmation activity of hyporheic meiofauna: first results from a new approach using anesthetizing subatances. Arch. Hydrobiol. (Advances in Limnology): The ecology of the hyporheic zone of running waters. Patterns, processes and bottleneck functions: 185-203.
Schneider, J. (2009): Erfolgskontrolle der Wiedereinbürgerung von Lachs (Salmo salar L.) und Meerforelle (Salmo trutta L.) in Sieg, Saynbach, Ahr und Lahn (Rheinland-Pfalz). – Projektphase V, 1. Zwischenbericht. Im Auftrag d. Landes Rheinland-Pfalz. Frankfurt a. M., 79 pp.
Schneider, J. (2010): Erfolgskontrolle der Wiedereinbürgerung von Lachs (Salmo salar L.) und Meerforelle (Salmo trutta L.) in Sieg, Saynbach, Ahr und Lahn (Rheinland-Pfalz). - Projektphase V, 2. Zwischenbericht. Im Auftrag d. Landes Rheinland-Pfalz. Frankfurt a. M., 79 pp.
Statzner, B. (2011): Bed-sediment engineering by running water, plants and animals: implications for sediment transport and morphodynamic processes. - EUROMECH Colloquium 523 Ecohydraulics: linkages between hydraulics, morphodynamics and ecological processes in rivers Clermont-Ferrand, France, 15-17 June 2011; p. 17-22.
Stewart, A.J. (1987): Responses of Stream Algae to Grazing Minnows and Nutrients: A Field Test for Interactions. - Oecologia
Vol. 72, No. 1 (1987), pp. 1-7.
Vaughn, C.C.; Gelwick, F.P. & Matthews, W.J. (1993): Effects of Algivorous Minnows on Production of Grazing Stream Invertebrates. - Oikos Vol. 66, No. 1, pp. 119-128.
Zwick, P. (1992): Fließgewässergefährdung durch Insektizide. - Naturwissenschaften 79: 437–442.
- Projektberichte finden Sie im Archiv - bitte hier klicken -